在化学研究和工业生产中,特定气体的制备、净化与收集是基础且至关重要的操作。这三个环节环环相扣,共同决定了最终获得气体的纯度、产量与安全性。它们不仅是化学原理的直观体现,也是实验技能的综合应用。
一、气体的制备:原理为先,方法为径
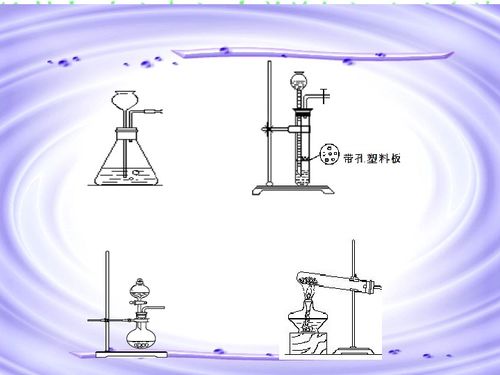
气体的制备主要依据特定的化学反应。根据反应物的状态(固态、液态)及反应条件(加热与否),实验室常用以下三种装置:
- 固体加热型:适用于反应物均为固体且需加热的反应,如实验室用氯酸钾与二氧化锰混合加热制取氧气。装置通常由铁架台、酒精灯和硬质试管组成。
- 固液不加热型:适用于块状固体与液体在常温下的反应,如用锌粒与稀硫酸反应制取氢气,或用石灰石(大理石)与稀盐酸反应制取二氧化碳。常用启普发生器或其简易装置,能随时控制反应的发生与停止。
- 固液或液液加热型:适用于反应物需在加热条件下进行的反应,如用氯化铵与氢氧化钙固体混合加热制取氨气。此时需用到圆底烧瓶、分液漏斗和热源。
选择何种制备方法,核心在于对目标气体化学性质的深刻理解及对反应速率、安全性和便利性的综合考虑。
二、气体的净化:去芜存菁,提纯是关键
从反应装置中导出的气体往往混有水蒸气、酸雾或其他副反应气体杂质,必须经过净化处理。净化的原则是:不损失主体气体、不引入新杂质、操作安全简便。
- 除杂试剂的选择:需根据杂质与目标气体的性质差异。例如,可用浓硫酸干燥酸性或中性气体(如CO₂、Cl₂),但不能干燥碱性气体(如NH₃);碱性干燥剂(如碱石灰)则用于干燥碱性气体。若混有酸性杂质(如HCl),可用碱性溶液(如NaOH溶液)洗气,但需确保目标气体不被吸收(如CO₂会被NaOH吸收,故不可用)。
- 装置顺序:通常先除其他化学杂质,最后干燥除去水蒸气。洗气瓶(长管进气,短管出气)是常用装置。
三、气体的收集:因“气”制宜,方法各异
收集方法完全取决于气体的物理性质(密度、溶解性)和化学性质(是否与空气或水反应)。
- 排水法:适用于不易溶于水且不与水反应的气体,如H₂、O₂、CO。此法收集的气体纯度较高。
- 向上排空气法:适用于密度比空气大(相对分子质量>29)且不与空气成分反应的气体,如CO₂、Cl₂、SO₂。集气瓶口向上,导管伸入瓶底。
- 向下排空气法:适用于密度比空气小(相对分子质量<29)且不与空气成分反应的气体,如H₂、NH₃。集气瓶口向下,导管伸入瓶底。
对于有毒或有害气体,必须在密闭系统或通风橱中进行,并对尾气进行适当处理(如吸收),防止污染。
###
气体的制备、净化与收集是一个系统性的工程。从反应原理的设计,到中间杂质的去除,再到最终产品的获取,每一步都蕴含着丰富的化学知识。掌握这些核心环节,不仅能保障实验的顺利进行与人身安全,更是理解物质转化、探索化学世界的重要基石。在实际操作中,必须严谨规划流程,灵活运用知识,才能高效、安全地获得所需气体。